SANTÉ INTESTINALE ET MALADIES
LA BARRIÈRE INTESTINALE, C'EST QUOI?
La barrière intestinale est composée de cellules appelées entérocytes et d'un "ciment" entre les cellules assurant une étanchéité.
Elle joue un rôle-clé de douanier: laisser passer les nutriments indispensables au travers de ses cellules au niveau principalement de l'intestin grêle et empêcher le passage de toute "mauvaise" molécule, virus, bactérie... qui pourrait être à l'origine d'une inflammation et d'une activation inappropriée du système immunitaire avec impact sur notre immunité, notre métabolisme et nos fonctions cérébrales.
LE MICROBIOTE, C'EST QUOI?
Le microbiote, constitué de bactéries, levures, virus et champignons, est un acteur principal.
Il est un peu comme une forêt tropicale où cohabite intelligemment tout un écosystème très diversifié d'arbres, oiseaux, plantes, animaux différents.
On comprend facilement qu'une forêt composée de quelques arbres et plantes sera plus fragile et moins résistante à l'hiver.
Tous ensemble, ces micro organismes produisent des milliers de composés puissants à l'origine des rôles que nous allons voir maintenant.
Si des mauvaises bactéries se développent dans le côlon, on parle de dysbiose. Si des bactéries pullulent dans l'intestin grêle, on parle de SIBO.
À QUOI SERVENT LES BONNES BACTÉRIES DANS LE CÔLON?
À TOUT CELA!!!!!!!

Rôle direct des micro organismes dans les intestins
- Assurent la "digestion" fermentation des déchets alimentaires grâce à des enzymes.
- Facilitent l’assimilation des nutriments grâce à un ensemble d’enzymes dont les cellules humaines sont dépourvues.
- Assurent la "cassure" de l’amidon, de la cellulose, des polysaccharides pour en faire des petites molécules de glucose que les cellules consomment...
- Participent à la synthèse de la vitamine K, certaines vitamines B et à trois acides aminés essentiels : la valine, la leucine et l’isoleucine.
- Régulent l'absorption des acides gras, du calcium, du magnésium...
- Assurent leurs propres besoins en puisant dans nos aliments notamment les fibres
- Assurent la fabrication de neurotransmetteurs comme sérotonine et le GABA
Axe cerveau-intestins
L'intestin possède 200 millions de neurones, faisant dire qu'il s'agit d'un deuxième cerveau.
Ce système nerveux permet:
- d’assurer la motricité intestinale pour faire progresser le bol fécal
- d'être en interaction étroite et bidirectionnelle avec le cerveau. On parle d’un axe microbiote-intestin-cerveau, à travers lequel les deux organes communiquent en mettant en jeu le nerf vague, l'axe hypothalamo-hypophyso-surrénalien, le système hormonal et immunitaire et des molécules qui existent à la surface de "mauvaises bactéries"
Rôle de compétition locale
Des bactéries comme Escherichia coli luttent directement contre la colonisation du tube digestif par des "mauvaises" espèces, par phénomène de compétition et par production de substances bactéricides
Rôle sur le fonctionnement du système immunitaire intestinal
C'est ce qui explique le rôle protecteur de la barrière intestinale. Dès les premières années de vie, le microbiote est en effet nécessaire pour que l’immunité intestinale apprenne à distinguer les espèces amies et ennemies.
Des animaux sans microbiote ont une motricité du tube digestif ralentie, des cellules intestinales imparfairtes, moins de cellules immunitaires locales, une rate et des ganglions anormaux, un bilan hormonal et nutritionnel perturbé
POUR LES CURIEUX...
QUAND LE MICROBIOTE SE DÉSÉQUILIBRE (DYSBIOSE)?
L’inflammation est un processus biologique important, étroitement corrélé à l’immunité.
Il est NORMAL d'avoir une réaction inflammatoire physiologique, indispensable à l’activation immunitaire et qui permet de neutraliser tout "agent ennemi".
Il est MAUVAIS d'avoir des réactions inflammatoires trop importantes. Très vite l'inflammation locale peut se propager aux autre organes ....
-----------> Présence d'antigènes inflammatoires, comme les lipopolysaccharides (LPS) présents à la surface de certaines bactéries Gram négatif.
----------> Déclenchement d'une réponse immunitaire
-----------> Production de cytokines
-----------> Explosion de l'inflammation locale
-----------> Porosité de la paroi intestinale ++
-----------> Passage des LPS au travers des "trous" qui arrivent dans le sang puis dans d'autres organes
-----------> Inflammation de ces autres organes.
PARTIE SUPÉRIEURE DU SCHÉMA: l'ingestion de certains aliments ou médicaments peuvent modifier le microbiote en mieux ou moins bien
PARTIE INFÉRIEURE: on constate les causes principales faisant pencher la balance vers la santé ou vers la maladie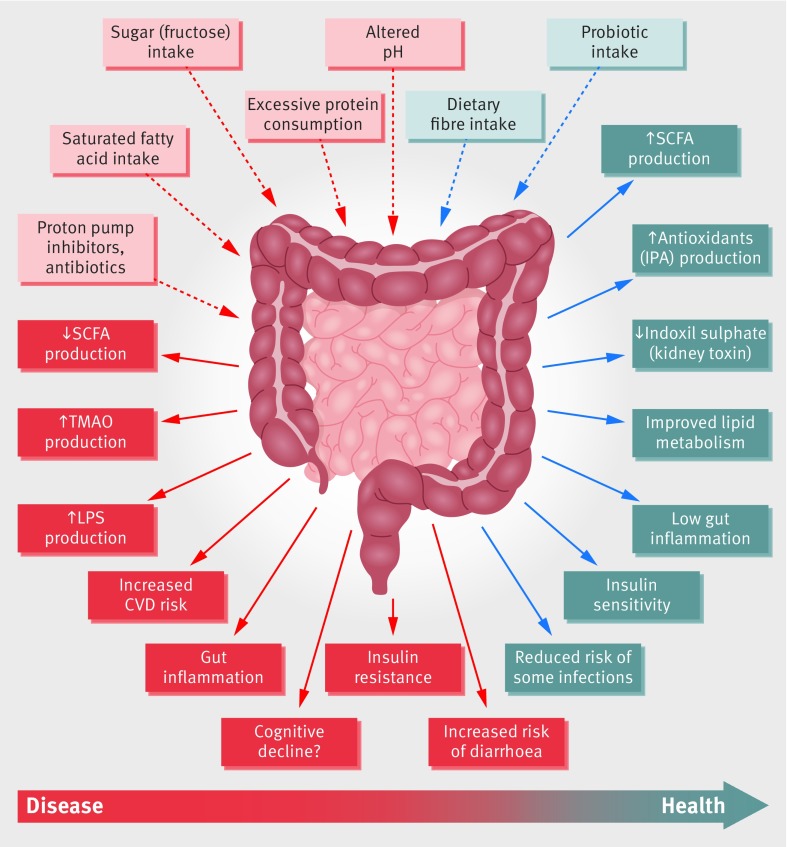
POUR LES TRÈS CURIEUX
LIENS ENTRE MICROBIOTE ET MALADIES
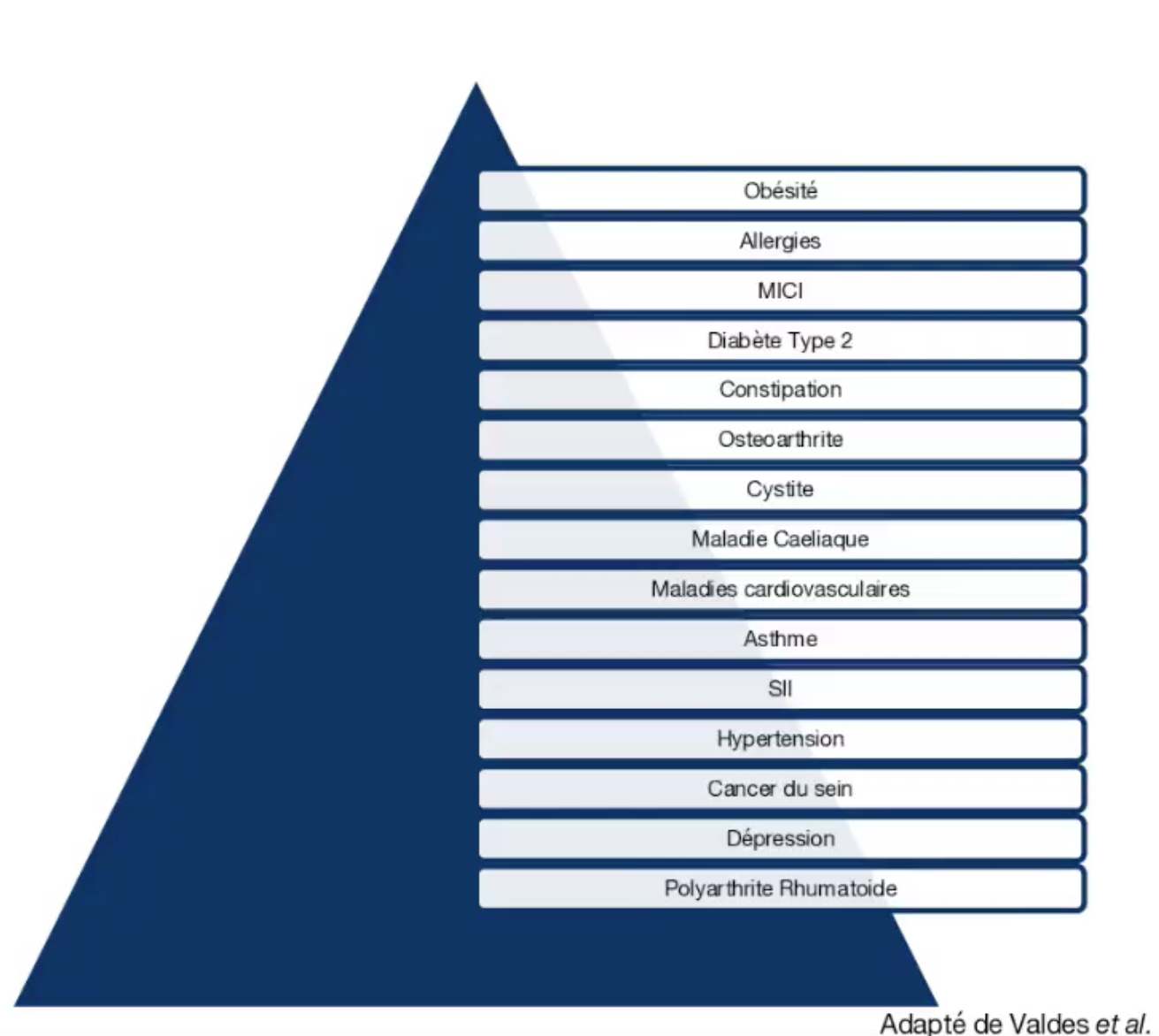
On considère qu'environ 90% des maladies ont un lien plus ou moins important avec un microbiote perturbé. L'équipe de Valdès and al fait de nombreuses publications. Dans ce tableau ci-dessous est synthétisée l'importance du rôle de la dysbiose dans la maladie. Dans le top 3, on retrouve en premier l'obésité pour laquelle, à la date d'aujourd'hu,i le lien est le plus fort, puis viennent les allergies alimentaires et maladies intestinales chroniques intestinales.
Lien entre microbiote et cancer
Rôle dans la "fabrication" d'un cancer
L'existence d’une dysbiose est décrite comme un facteur qui peut favoriser l’apparition ou la progression d’un cancer, selon différents mécanismes :
- Le premier est celui de la cancérogenèse elle-même. Certaines tumeurs sont liées à la présence de micro-organismes précis, ou à celle d’une dysbiose intestinale. Dans le premier cas, le pathogène est responsable de lésions dans l’ADN, par exemple grâce à des toxines. C’est notamment le cas avec Helicobacter pylori, une bactérie qui augmente le risque de survenue des cancers gastriques. Dans le second cas, le déséquilibre du microbiote favorise certaines espèces (Fusobacterium) capables de stimuler anormalement des voies cellulaires carcinogènes, comme celle de la caténine. Des études de cohorte indiquent que la dysbiose engendrée par des antibiothérapies fréquentes est corrélée à une incidence accrue de cancer du sein chez les femmes.
- Un deuxième mécanisme tient au lien étroit entre le microbiote et l’immunité locale. La littérature décrit plusieurs voies de signalisation pro-inflammatoires ou immunosuppressives qui sont particulièrement activées en cas de dysbiose. Dans d’autres cas, cette dernière augmente la perméabilité intestinale, ce qui permet le passage de composés oncogéniques de la lumière intestinale vers l’organisme. Chez l’humain, de tels mécanismes ont été rapportés dans le cadre de pathologies tumorales touchant le côlon, l’estomac, l’œsophage, le pancréas ou encore le foie.
- Des anomalies du microbiote auraient aussi la capacité de conduire à l’activation de gènes liés à la survie des cellules cancéreuses. Elles favoriseraient ainsi la progression tumorale. Ce phénomène concernerait des cancers de la sphère intestinale, mais s’observerait aussi à distance du tube digestif.
- Plus récemment, des bactéries ont été mises en évidence au sein des tumeurs elles-mêmes : comprendre leur nature, l’origine de leur présence et leur influence sur le tissu cancéreux pourrait apporter de nouvelles pistes thérapeutiques.
Action sur l’efficacité des traitements
Les probiotiques sont prometteurs pour soulager certains effets indésirables associés aux traitements anticancéreux conventionnels, qui nécessitent souvent d’augmenter les doses de médicaments et de retarder ou d’arrêter les thérapies.
Les lésions intestinales représentent une complication majeure des chimiothérapies et des radiothérapies, se présentant principalement sous la forme de diarrhée et de mucite : une affection inflammatoire/ulcéreuse douloureuse de la muqueuse. La chimiothérapie et la radiothérapie peuvent également entraîner des mucites dans les régions oropharyngées, cet événement est très fréquent chez les patients traités pour des cancers de la tête et du cou.
L’apport de probiotiques chez les patients subissant une radiothérapie adjuvante pour un cancer de l’intestin ou du col de l’utérus a significativement diminué l’occurrence, l’incidence et la gravité de la diarrhée et le nombre de selles quotidiennes de l’entérocolite et a retardé l’utilisation de médicaments antidiarrhéiques. Cela a permis à un plus grand nombre de patients de terminer le traitement anticancéreux par rapport au groupe placebo.Il existe une synergie d’action entre le microbiote et certains médicaments utilisés dans le traitement des cancers.
Le cyclophosphamide, chimiothérapie couramment utilisée en oncologie, augmente la perméabilité intestinale. De là, certaines bactéries entrent dans le sang et provoquent une réponse immunitaire. Certains médiateurs de cette réponse ont des propriétés anticancéreuses.
L’immunothérapie anticancéreuse fait sauter certains points de contrôle immunitaires qui freinent les défenses de l’organisme face aux cellules tumorales. Beaucoup de patients n'y sont pas répondeurs. L’une des causes résiderait dans la composition de leur microbiote intestinal. En effet, dans différentes pathologies tumorales, la survie des patients qui ont été traités par une antibiothérapie avant immunothérapie est moins bonne que celle des autres patients. La présence de bactéries de la famille des Akkermansia, Ruminocaccaceae et du genre Fecalibacterium serait déterminante pour obtenir une réponse positive au traitement. Deux essais préliminaires, regroupant 25 patients, ont montré que la transplantation fécale depuis des patients répondeurs à l’immunothérapie vers des « non répondeurs » améliore la réponse antitumorale chez ces derniers. Les probiotiques améliorent également les résultats des protocoles d’immunothérapie anti-cancer. Une taille tumorale nettement réduite, une expression réduite de Ki67, une apoptose accrue, une inhibition du potentiel métastatique et le passage d’un microenvironnement immunosuppresseur à un microenvironnement immunostimulant ont été observés dans le traitement combiné par rapport à l’immunothérapie seule. Cependant, une étude préliminaire très récente suggère que la prise de probiotiques chez les patients atteints de mélanome réduit de 70 % la réponse à l’immunothérapie anti-PD1, diminuant probablement la diversité du microbiote intestinal. Ces résultats controversés, qui entrent en conflit avec la perception générale des probiotiques comme étant bénéfiques et avec les résultats antérieurs, méritent des investigations plus approfondies.
Zoom sur le microbiote et le cancer colique
Les bactéries Bifidobactéria et Lactobacilli contribuent au maintien de la réponse immunitaire. Parfois, elles ne font plus le poids face à l'arrivée de "mauvaises bactéries" pro-inflammatories venant de la bouche et qui ont pu passer le filtre gastrique.
Le régime occidental riche en protéines animales et sucres favorise les "mauvaises" bactéries pro-inflammatoires. En l'absence d'un apport suffisant de fibres, les mauvaises bactéries surabondantes, qui sont affamées, se nourrissent du mucus, ce qui rend la paroi intestinale très poreuse et donc vulnérable aux attaques. Au niveau cellulaire, cette alimentation sur stimule la production locale de cytokines pro-inflammatoires. Une inflammation chronique du colon s'installe favorisant le risque de cancérisation recto-colique. Chez l'animal, Escherichia Coli et Bacteroides Fragilis entretiennent la stimulation inflammatoire colique, favorisent la survenue de cancers. Elles sont d'ailleurs surabondantes dans le cancer du côlon stade avancé.
L’irinotécan, administré pour traiter le cancer colorectal avancé conduit fréquemment à une toxicité intestinale. Les patients prenant des probiotiques quotidiennement pendant la chimiothérapie avaient moins d’incidence et de gravité de la diarrhée, et moins d’entérocolite et de ballonnements.
La supplémentation quotidienne en L. rhamnosus GG chez les patients atteints de cancer colorectal au cours d’une chimiothérapie adjuvante à base de 5-FU diminue la diarrhée sévère, l’inconfort abdominal et la nécessité de réduire les doses de chimiothérapie par rapport aux patients ne recevant pas de probiotiques.
Lien entre microbiote, COVID-19 et vaccins
À New York, la diarrhée était le symptôme de présentation chez 23,7 % des premiers patients enregistrés et est restée supérieure à 20 % au cours de l'année qui a suivi.
Ce premier constat est très interpelant quand on sait que la diarrhée n'était présente que chez 3,8 % des patients à Wuhan au cours de la même période, ce qui donne à penser que ce symptôme est fortement influencé par le régime alimentaire et par le microbiote qui se développe en corollaire. La présence de symptômes gastro-intestinaux semble aussi globalement associée à des formes plus sévères de l'infection.
La composition du microbiote chez les patients COVID, qui est très différente des individus non infectés, reflète la gravité de la maladie et les réponses immunitaires dysfonctionnelles chez les patients atteints de COVID que les patients aient pris ou non des antibiotiques.
Les patients COVID manquent de certaines bonnes bactéries (Faecalibacterium prausnitzii, Eubacterium rectale et plusieurs espèces bifidobactériennes) connues pour réguler le système immunitaire. Le déséquilibre microbien est corrélé à des concentrations élevées de marqueurs de l'inflammation (cytokines, CRP, LDH, ASAT et gamma GT) dans le sang.
Ce déséquilibre du microbiote persiste 1 mois après la résolution de la maladie. Ces altérations pourraient jouer un rôle dans la maladie COVID de longue durée.
Dans une étude chinoise (3), en donnant une formule d'immunité au microbiome aux patients, Dr Ng conclut « Par rapport aux patients bénéficiant de soins standard, notre étude clinique pilote a montré que davantage de patients COVID ayant reçu notre formule d'immunité au microbiome obtenaient une résolution complète des symptômes, présentaient des marqueurs pro-inflammatoires significativement réduits dans le sang, avaient plus de bactéries favorables dans les selles; et développaient un anticorps neutralisant ... Nos résultats suggèrent que la dysbiose affaiblit notre défense immunitaire, prédisposant ainsi à une infection plus sévère du SRAS-CoV-2 et contribuant à un « COVID de longue durée », a déclaré le Dr. Ng . « Les probiotiques, s'ils utilisent la bonne combinaison de bactéries manquantes pour renforcer l'immunité, peuvent être potentiellement utiles comme traitement adjuvant. ».
Ce déséquilibre du microbiote persiste après 1 mois après la résolution de la maladie.... voire après. en effet, des recherches ont révélé que les formes longues du COVID s'accompagnent d'une modification du microbiote, avec une nette réduction du nombre de certains micro-organismes possédant un potentiel immuno modulateur.
Une étude (2) est même parvenue à la conclusion que les vaccins covid aussi sont sensibles à la composition de notre flore intestinale, et que le taux de certaines bactéries bien spécifiques (et différentes d'un vaccin à l'autre) peut en accroître l'efficacité. D'après ses auteurs, la composition basale du microbiote permettrait même de prédire la réponse immunitaire aux divers vaccins COVID après un mois. Au-delà de cet impact sur l'efficacité des vaccins, les bactéries présentes dans l'intestin semblaient aussi avoir une influence sur leurs effets secondaires.
Plus étonnant peut-être, à l'inverse, la vaccination covid affectait aussi clairement le microbiote des patients, provoquant une baisse de la diversité bactérienne et une diminution de l'abondance de nombreuses souches courantes…
À suivre...
Sources :
1. https://gut.bmj.com/content/early/2021/01/04/gutjnl-2020-323020
2. Leung JSM. Interaction between gut microbiota and COVID-19 and its vaccines. World J Gastroenterol 2022; 28(40): 5801-5806 – https://dx.doi.org/10.3748/wjg.v28.i40.5801
Lien entre microbiote et maladies intestinales
Les maladies inflammatoires chroniques de l’intestin (MICI), comme la maladie de Crohn et la rectocolite hémorragique, sont liées à une activation inappropriée du système immunitaire dans l’intestin. Derrière leur survenue se cachent des facteurs génétiques et environnementaux (alimentation, âge…). Le rôle du microbiote a été suspecté devant l’amélioration des symptômes de patients sous traitement antibiotique, ou encore en raison de la disparition de lésions inflammatoires intestinales chez des personnes dont la paroi intestinale n’est plus au contact des fèces (suite à la mise en place d’une dérivation fécale). Ceci s’explique probablement par le rôle des bactéries intestinales et leurs métabolites dans l’équilibre de la réponse immunitaire locale.
Des dysbioses associées aux MICI ont été décrites. Elles sont caractérisées par un déficit en certaines bactéries, comme Faecalibacterium prausnitzii ou d’autres espèces du groupe Clostridium, ainsi que par une augmentation de la population d’autres bactéries pro-inflammatoires comme les entérobactéries ou les bactéries du genre Fusobacterium. On pense que ces déséquilibres sont à la fois une cause et une conséquence de la maladie : la dysbiose apparaîtrait sous l’influence de facteurs génétiques et environnementaux, mais jouerait elle-même un rôle dans le démarrage, le maintien ou la sévérité de l’inflammation, engendrant un cercle vicieux. Le rôle des métabolites bactériens dans ces mécanismes est aussi suspecté.
Parmi les dizaines de gènes de prédisposition aux MICI aujourd’hui identifiés, certains jouent un rôle déterminant vis-à-vis du microbiote. C’est par exemple le cas du gène NOD2, dont les variations sont celles qui ont le plus de poids dans le risque de survenue de la maladie de Crohn en occident. Or ce gène code pour un récepteur de l’immunité innée, chargé de détecter un composant de la paroi bactérienne. Muté, il ne peut plus jouer ce rôle et favoriser le maintien de la barrière intestinale. Autre exemple, celui des polymorphismes qui affectent le gène CARD9, également impliqué dans la reconnaissance des micro-organismes par l’immunité innée. Son dysfonctionnement favorise le déséquilibre du microbiote et l’instauration d’une inflammation au niveau local.
Lien entre microbiote et maladies cardiovasculaires/ métaboliques
Les maladies cardio- et cérébrovasculaires (athérosclérose, hypertension, AVC…) et cardiométaboliques (diabète, obésité) ont une origine multifactorielle, à la fois génétique, nutritionnelle et environnementale. Il apparaît de plus en plus clairement que le microbiote intestinal joue un rôle dans leur genèse.
Pour exemple, l’implantation d’un microbiote d’une souris obèse chez une souris axénique provoque une prise de poids importante et rapide chez cette dernière. On sait aussi que la prise d’antibiotiques au long cours peut avoir une incidence sur le risque de développer une maladie cardiovasculaire.
Plusieurs mécanismes pourraient être à l’origine de ces relations : dans le diabète ou l’obésité, la forte proportion de graisses dans l’alimentation augmente la pourcentage de bactéries Gram négatif dans l’intestin, provoquant une inflammation chronique (voir plus haut Microbiote et inflammation). Le LPS est ensuite capable de passer dans la circulation sanguine, dans le foie, les tissus adipeux, musculaires… où il y favorise l’installation d’une inflammation chronique à bas bruit. Celle-ci va à son tour favoriser l’apparition d’une insulinorésistance, préalable au diabète et à l’obésité.
D’autres mécanismes qui impliquent le microbiote entrent probablement aussi en jeu : l’augmentation de la perméabilité de la paroi intestinale pourrait laisser passer des bactéries entières. Leur implantation durable au niveau des tissus adipeux, musculaires et hépatiques participerait alors au maintien de l’inflammation locale.
Lien entre microbiote et maladies neurodégénératives comme la maladie d'Alzheimer
L'axe microbiote-intestin-cerveau permet une communication entre les deux organes en mettant en jeu le nerf vague, l'axe hypothalamo-hypophyso-surrénalien, le système hormonal et immunitaire et des molécules qui existent à la surface de "mauvaises bactéries" (LPS des bactéries Gram-négatif et le peptidoglycane des bactéries Gram positif).
- Ainsi un déséquilibre du microbiote pourrait modifier l’information transmise de l'intestin vers le cerveau ou du cerveau vers l'intestin, modifiant ainsi le fonctionnement des deux organes ainsi que du nerf vague.
- Ceci favorisait la neuro-inflammation et les lésions neuronales.
- Des données récentes suggèrent qu’une dysbiose pourrait être un élément précoce dans le développement de certaines pathologies neurodégénératives telles que la maladie de Parkinson. Dans cette dernière, des peptides amyloïdes produits par certaines espèces bactériennes (Escherichia coli) peuvent favoriser la production de peptides amyloïdes dans le système nerveux et le cerveau de l’hôte – notamment des formes agrégées d’alpha-synucléine. Cela contribuerait aux troubles digestifs et comportementaux.
- De plus, la place du tube digestif dans l’origine de certaines formes de la maladie de Parkinson est renforcée par le fait que l’alpha-synucléine pathologique présente dans le tube digestif peut se propager jusqu’au cerveau, via le nerf vague. Elle y provoque des cascades d’agrégation qui favorisent le développement de la maladie. D’ailleurs, il est démontré que l’incidence de cette maladie est moins élevée chez les personnes qui ont eu une vagotomie (section du nerf vague).
- La gravité des symptômes parkinsoniens est en outre corrélée à la concentration d’une espèce bactérienne particulière (Entérobactericeae) dans le microbiote des patients.
- Dans la maladie d'Alzheimer (MA), une récente étude montre qu'il existe un lien étroit entre certaines bactéries intestinales et la MA:
- Corrélation significative entre 10 types spécifiques de bactéries intestinales et la probabilité de développer la MA.
- Six catégories de bactéries ont été identifiées comme protectrices vis à vis de la MA : Adlercreutzia, groupe Eubacterium nodatum, Eisenbergiella, groupe Eubacterium fissicatena, Gordonibacter et Prevotella.
- Quatre types de bactéries ont été identifiées comme représentant un facteur de risque pour la MA : Collinsella, Bacteroides, Lachnospira et Veillonella; ces bactéries étaient significativement associées à l'allèle de risque APOE .
- Ainsi des facteurs génétiques de l'hôte (APOE) influencent le développement de bactéries significativement associés à la MA.
- En 2022, des chercheurs suisses et italiens ont confirmé la corrélation entre déséquilibre du microbiote intestinal et développement des plaques amyloïde dans le cerveau humain, chez des patients atteints de MA. Certaines protéines produites par des bactéries intestinales (liées à des mauvaises habitudes alimentaires et le vieillissement par exemple), identifiées dans le sang des malades, pourraient modifier l’interaction entre le système immunitaire et le système nerveux et déclencher la maladie d'Alzheimer.
Source:
Cammann D, Lu Y, Cummings MJ, et al. : Genetic correlations between Alzheimer's disease and gut microbiome genera. Sci Rep. 2023;13(1):5258. doi:10.1038/s41598-023-31730-5)
Lien entre microbiote et troubles du neurodéveloppement
Chez l’humain, il est décrit que les troubles du spectre autistique (TSA) sont plus fréquents parmi les enfants nés de mères obèses – un trouble métabolique souvent associé à une dysbiose. D’autre part, des études indiquent que le risque de TSA serait significativement accru chez certains enfants dont la mère a souffert d’une infection (grippe, gastro-entérite…) lors du premier trimestre de grossesse. La même observation a pu être répliquée chez la souris : des souriceaux nés de mères infectées au cours de la période gestationnelle développent des troubles du comportement comparables aux TSA observés chez l’humain. En traitant la mère par antibiotiques, il semble possible d’empêcher cette évolution. Des troubles immunitaires, délétères pour le SNC du fœtus, seraient consécutifs aux perturbations induites par la dysbiose de la mère elle-même induite par l’infection.
Selon le même rationnel, des recherches cliniques menées chez les personnes qui souffrent de TSA suggèrent qu’une amélioration de certains symptômes pourrait être obtenues après administration de traitements antibiotiques spécifiques ou de microbiote sain.
Lien entre microbiote et troubles psychologiques/psychiatriques
D’autres pathologies comme la dépression, l'anxiété, la schizophrénie ou les troubles bipolaires pourraient aussi être concernées par des modifications de la composition du microbiote.
Dans le cas de la dépression, étant donné que les microbes intestinaux affectent la communication de l'axe intestins-cerveau, ils contribuent très probablement à la dépression. Pendant longtemps, les recherches et les traitements de la dépression se sont concentrés sur les anomalies structurelles et fonctionnelles du cerveau.
Le microbiote est un parmi de nombreux autres facteurs – génétiques, épigénétiques, environnementaux, psychologiques… – à jouer un rôle déterminant dans le déclenchement de ces maladies.
Chez les personnes atteintes de schizophrénie ou de troubles bipolaires, par exemple, l’équilibre entre les différentes cytokines pro- ou anti-inflammatoires présentes dans le sang est perturbé, notamment sous l’action du LPS (molécules à la surface des "mauvaises" bactéries Gram négatif).
Aussi, les perspectives thérapeutiques sont nombreuses : des études préliminaires ont montré que l’administration de certains probiotiques permettait d’améliorer les symptômes d’anxiété ou de dépression chez des personnes malades.
Une étude randomisée montre qu'en suivant des patients dépressifs sous traitement, 30% ayant bénéficié d'un suivi régulier par un diététicien pendant trois mois ont eu une rémission clinique complète de leur dépression contre 8% pour ceux qui n'avaient eu qu'un soutien social. Lien
Une étude de 2018 Lien a montré que les régimes sans produits ultra transformés et comprenant d'importantes quantités de végétaux, sont associés à une meilleure santé mentale et diminuent de 30 à 35% le risque de dépression, indépendamment du niveau d'éducation, de revenus et de l'indice de masse corporelle
Source:
https://www.inserm.fr/dossier/microbiote-intestinal-flore-intestinale/
Vous souhaitez améliorer votre santé intestinale? Nous pouvons en parler ensemble au cabinet ou en visioconférence
